Contents
▶ 열역학을 다루는 포스팅
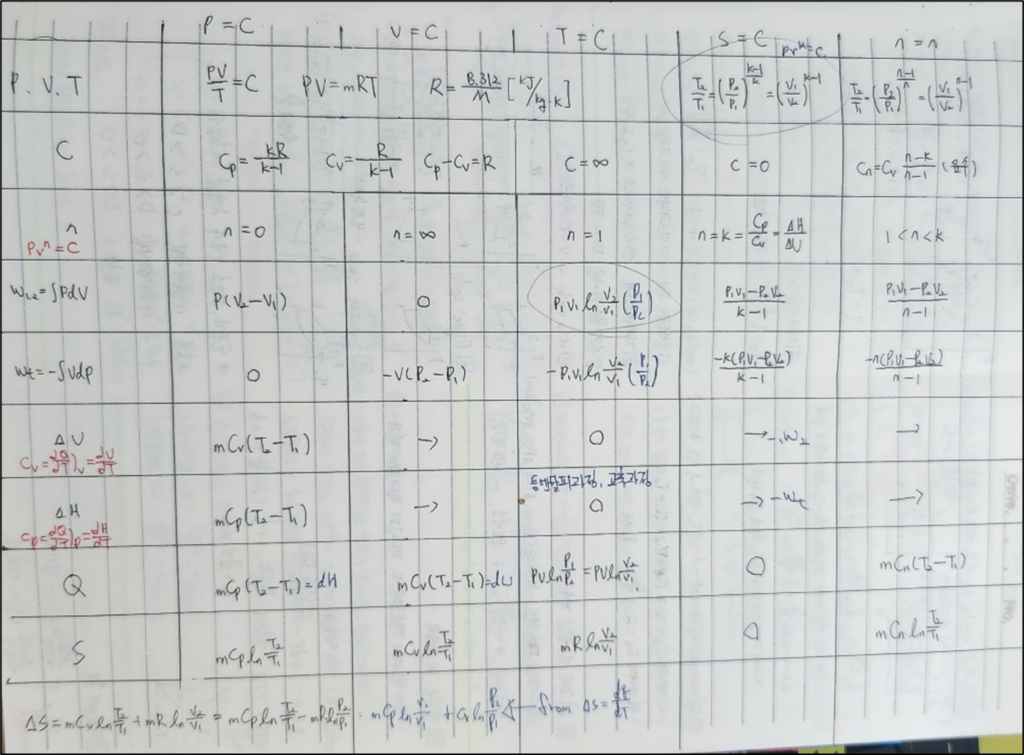
Section 05) 열역학 제 2법칙

1. 켈빈-플랑크 법칙
- 정의: 켈빈-플랑크 법칙은 열역학 제 2법칙의 하나로, 단일 열원에서 작동하는 열기관이 그 열원으로부터 받은 열을 완전히 일로 변환할 수 없다는 원리를 말합니다.
- 중요성: 이 법칙은 열기관의 효율성에 한계가 있음을 나타내며, 무한한 일을 얻을 수 없다는 열역학적 한계를 설명합니다.
1) 기본 개념
- 켈빈-플랑크 법칙의 기술적 표현:
모든 열기관은 어떤 양의 열을 흡수하고, 일부를 일로 변환하며, 나머지는 낮은 온도의 열원에 열로 방출해야 한다.
2) 예제 및 풀이
예제 1:
- 문제: 단일 열원에서 작동하는 열기관이 1000 J의 열을 흡수하고, 600 J의 일을 수행했다면, 남은 열 에너지는 얼마인가요?
- 풀이: \( \text{남은 열 에너지} = \text{흡수한 열} – \text{수행한 일} = 1000 \, \text{J} – 600 \, \text{J} = 400 \, \text{J} \)
예제 2:
- 문제: 열기관이 500 J의 열을 흡수하여 300 J의 일을 수행한다면, 열기관의 효율은 얼마인가요?
- 풀이: \( \text{효율} = \frac{\text{수행한 일}}{\text{흡수한 열}} = \frac{300 \, \text{J}}{500 \, \text{J}} = 0.6 \, \text{또는} \, 60\% \)
이 예제와 풀이는 켈빈-플랑크 법칙의 적용을 이해하고 실제 문제에 적용하는 데 도움이
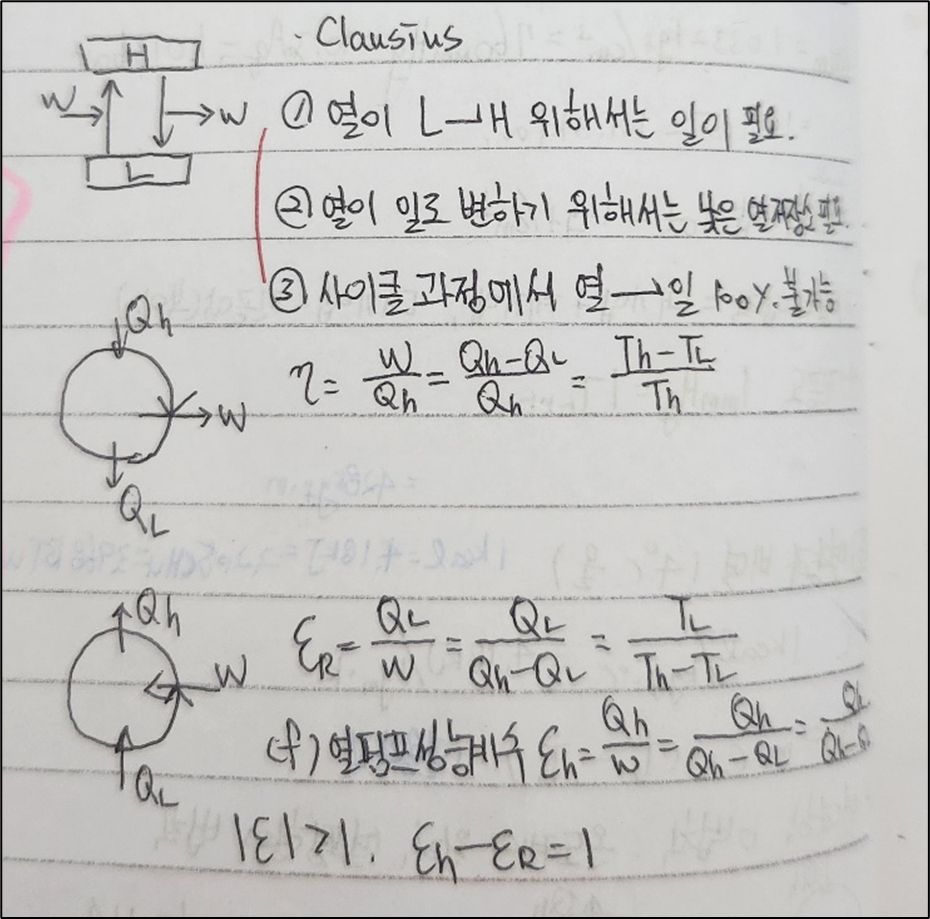
2. 클라우지우스 법칙
- 정의: 클라우지우스 법칙은 열역학 제 2법칙의 한 형태로, 높은 온도에서 낮은 온도로 열이 자발적으로 이동하지만 그 반대는 일어나지 않는다는 원리입니다.
- 중요성: 이 법칙은 열의 자연스러운 흐름과 관련하여 열기관 및 냉동기 같은 열역학적 시스템의 기본 원리를 설명합니다.
1) 예제 및 풀이
예제 1:
- 문제: 뜨거운 커피잔이 실온에 놓여 있을 때, 열은 커피에서 주변으로 이동합니다. 이 현상이 클라우지우스 법칙을 어떻게 보여주는가요?
- 풀이: 커피잔의 열이 자연스럽게 더 차가운 주변 환경으로 이동하는 것은 클라우지우스 법칙의 예입니다. 열은 높은 온도에서 낮은 온도로 이동하지만, 그 반대는 자연스럽게 일어나지 않습니다.
예제 2:
- 문제: 냉장고가 작동할 때, 내부의 열이 외부로 이동합니다. 이 과정이 클라우지우스 법칙을 위반하지 않는 이유는 무엇인가요?
- 풀이: 냉장고는 외부의 일(전기 에너지)을 사용하여 내부의 열을 더 높은 온도인 외부로 이동시킵니다. 이는 열이 자연스럽게 낮은 온도에서 높은 온도로 이동하지 않기 때문에, 외부의 일이 필요한 것이며, 클라우지우스 법칙에 위배되지 않습니다.
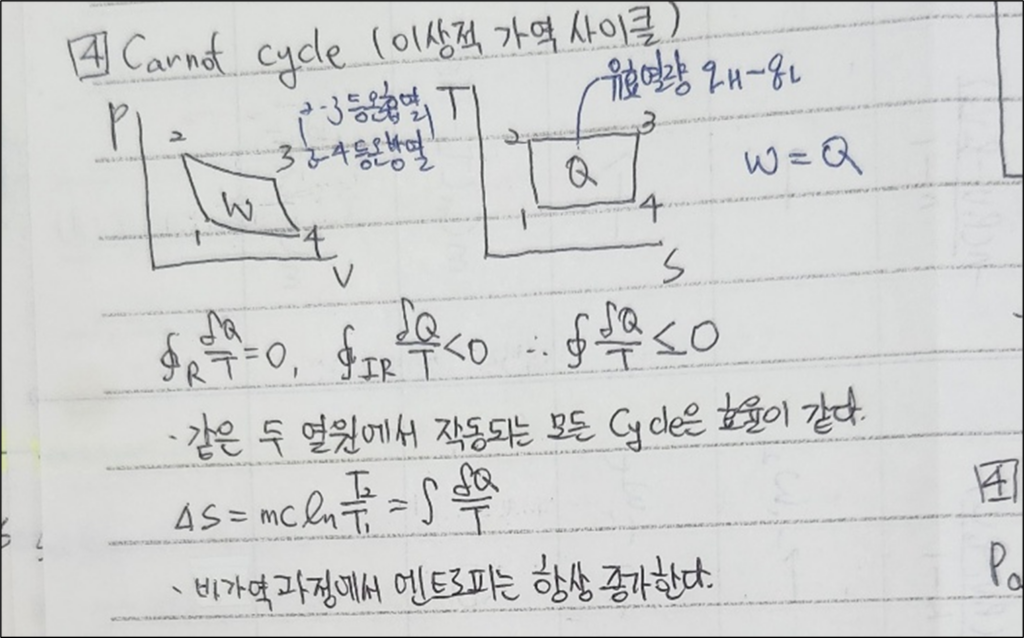
3. 카르노 사이클
- 정의: 카르노 사이클은 열역학에서 이상적인 열기관 사이클로, 두 개의 등온 과정과 두 개의 단열 과정으로 구성됩니다. 이 사이클은 이상적인 최대 효율을 제공합니다.
- 중요성: 카르노 사이클은 열기관의 이상적인 작동 원리를 이해하는 데 중요하며, 모든 실제 열기관의 효율은 카르노 사이클의 효율을 초과할 수 없습니다.
1) 기본 수식
- 카르노 사이클의 효율: \( \eta = 1 – \frac{T_{\text{low}}}{T_{\text{high}}} \)
2) 예제 및 풀이
예제 1:
- 문제: 고온 열원의 온도가 500K이고 저온 열원의 온도가 300K인 카르노 열기관의 효율을 계산하시오.
- 풀이: \( \eta = 1 – \frac{T_{\text{low}}}{T_{\text{high}}} = 1 – \frac{300}{500} = 1 – 0.6 = 0.4 \, \text{또는} \, 40\% \)
예제 2:
- 문제: 카르노 열기관이 600K의 고온 열원에서 작동하고, 40%의 효율을 가진다면, 저온 열원의 온도는 얼마인가요?
- 풀이:
\( \eta = 1 – \frac{T_{\text{low}}}{T_{\text{high}}} \Rightarrow 0.4 = 1 – \frac{T_{\text{low}}}{600} \)
\( T_{\text{low}} = 600 \times (1 – 0.4) = 600 \times 0.6 = 360K \)
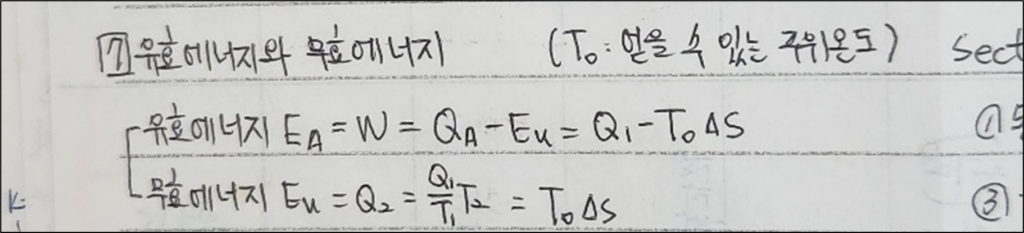
4. 유효에너지와 무효에너지 (Exergy and Anergy)
- 유효에너지 (Exergy): 시스템이 주변 환경과의 상호작용을 통해 최대한 수행할 수 있는 일의 양을 나타냅니다. 유효에너지는 시스템이 활용할 수 있는 ‘유용한’ 에너지입니다.
- 무효에너지 (Anergy): 시스템이 일을 수행하는 데 사용할 수 없는 에너지의 양입니다. 무효에너지는 환경과 열적으로 평형 상태에 있는 에너지 부분을 나타냅니다.
1) 기본 수식
- 유효에너지 계산: \( Exergy = U + P_0V – T_0S \)
2) 예제 및 풀이
예제 1:
- 문제: 500 J의 내부에너지, 1 atm의 주변 압력, 2L의 부피, 298K의 주변 온도, 100 J/K의 엔트로피를 가진 시스템의 유효에너지를 계산하시오.
- 풀이:
\( Exergy = 500 \, \text{J} + (1 \times 10^5 \, \text{Pa}) \times (2 \times 10^{-3} \, \text{m}^3) – (298 \, \text{K}) \times (100 \, \text{J/K}) \)
\( = 500 + 200 – 29800 = -29100 \, \text{J} \)
예제 2:
- 문제: 1000 J의 에너지를 가지고, 주변 환경과 열적으로 평형 상태에 있는 시스템의 무효에너지는 얼마인가요?
- 풀이: 시스템이 환경과 열적으로 평형 상태에 있으므로, 모든 에너지는 무효에너지입니다. \( Energy = 1000 \, \text{J} \)

5. 교츅과정 및 줄-톰슨 계수 (Throttling Process and Joule-Thomson Coefficient)
- 교츅과정 (Throttling Process): 압력이 감소하는 과정에서 가스의 온도 변화를 관찰하는 과정입니다. 이 과정에서 엔탈피는 일정하게 유지됩니다.
- 줄-톰슨 계수 (Joule-Thomson Coefficient): 교츅과정 중 온도 변화를 압력 변화로 나눈 값으로, 가스의 특성을 나타냅니다. 이 계수는 온도와 압력의 함수로 나타낼 수 있습니다.
1) 기본 수식
- 줄-톰슨 계수의 수식 \( \mu_{JT} = \left( \frac{\partial T}{\partial P} \right)_H \)
2) 예제 및 풀이
예제 1:
- 문제: 일정한 엔탈피를 유지하면서 가스가 5 atm에서 1 atm으로 압력이 감소했을 때, 온도가 3°C 감소했다면, 줄-톰슨 계수를 계산하시오.
- 풀이: \( \mu_{JT} = \left( \frac{\partial T}{\partial P} \right)_H = \frac{-3 \, \text{°C}}{5 \, \text{atm} – 1 \, \text{atm}} = -0.75 \, \text{°C/atm} \)
예제 2:
- 문제: 가스가 10 atm에서 2 atm으로 압력이 감소했을 때, 온도가 5°C 증가했다면, 이 가스의 줄-톰슨 계수는 얼마인가요?
- 풀이: \( \mu_{JT} = \left( \frac{\partial T}{\partial P} \right)_H = \frac{5 \, \text{°C}}{10 \, \text{atm} – 2 \, \text{atm}} = 0.625 \, \text{°C/atm} \)
다른 기계 가공법 링크
